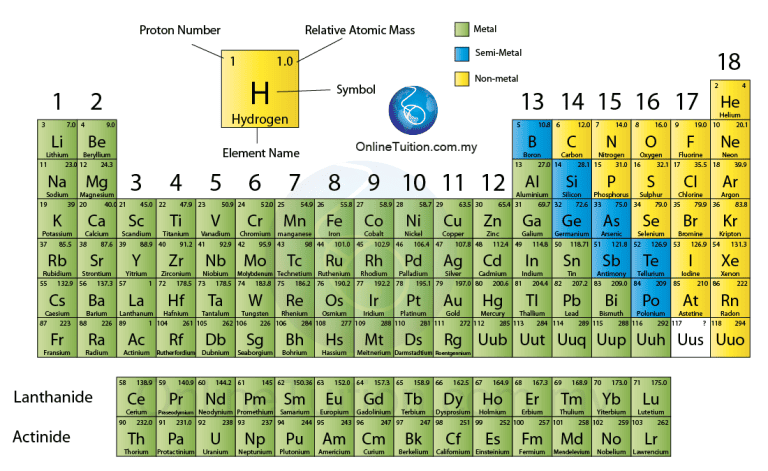
Jadual Berkala merupakan susunan unsur yang ada disekeliling yang dikelaskan berdasarkan unsur kimia yang diketahui dalam bentuk jadual mengikut ciri-ciri tertentu.
Banyak teori yang telah ditemui oleh ahli sains sebelum Jadual Berkala Unsur moden yang digunakan masa kini dihasilkan.
Struktur jadual ini adalah hasil eksperimen dan pemerhatian berbilang abad dari seluruh dunia.
Sejarah ringkas penciptaan Jadual Berkala
Sejak abad ke-18 lagi, beberapa orang ahli sains telah bertungkus lumus untuk cuba mengelaskan unsur sehingga terhasilnya Jadual Berkala Unsur yang digunakan sekarang.
Ahli-ahli kimia yang dimaksudkan adalah:
- Antoine Lavoisier (1743 – 1794)
- John Dalton (1766 – 1844)
- Johann W. Dobereiner (1780 – 1849)
- John Newlands (1837 – 1898)
- Lothar Meyer (1830 – 1895)
- Dmitri Mendeleev (1839 – 1907)
- H.J.G. Mosley (1887 – 1915)
Pengkelasan unsur Jadual Berkala
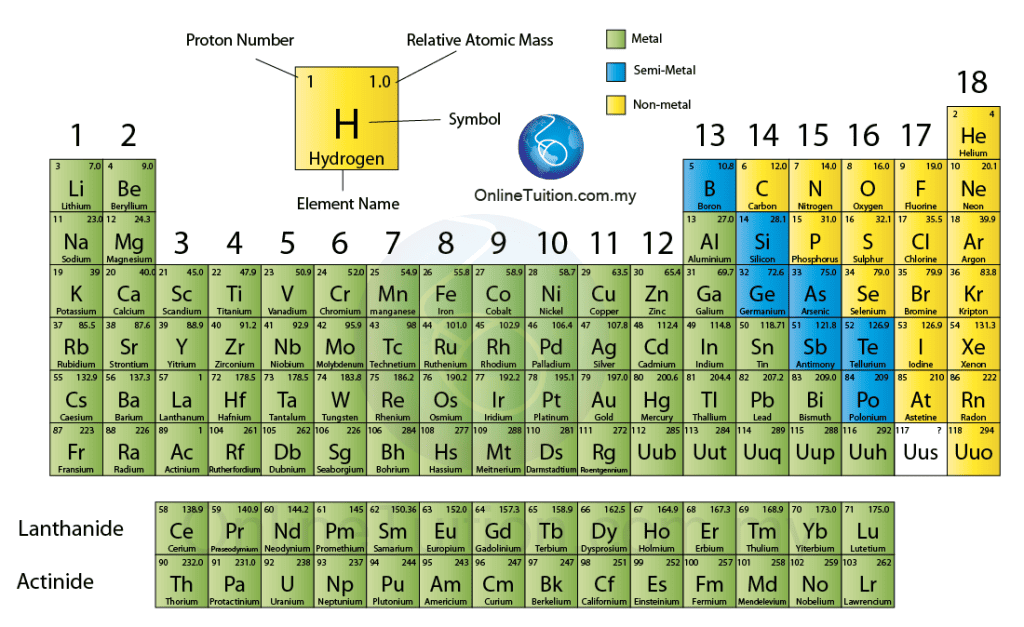
Pada masa ini jadual berkala terdiri daripada 118 unsur, yang dikelaskan kepada kumpulan berikut:
- gas berharga ,
- bukan logam,
- logam (termasuk logam alkali, logam alkali tanah, logam blok p, logam peralihan),
- separuh logam,
- lantanida,
- aktinida,
- halogen
Jadual ini juga mengandungi unsur-unsur yang masih tertakluk kepada penyelidikan dan diklasifikasikan ke dalam kumpulan unsur dengan sifat yang tidak diketahui (ini termasuk, sebagai contoh, Moscovium transuranik dan Oganesson sintetik yang tidak wujud sebagai deposit semula jadi bumi).
Prinsip Asas Penyusunan
Unsur dalam Jadual Berkala Unsur disusun mengikut tertib nombor proton yang menaik, iaitu daripada 1 hingga 118 – secara sistematik mengikut tertib menaik nombor proton dari kiri ke kanan dan dari atas ke bawah.
Susunan unsur dibincangkan dari aspek kumpulan, kala, nombor proton dan susunan elektron.
Artikel berkaitan: Kalendar 2024: Tarikh Cuti Umum dan Cuti Sekolah KPM
Kumpulan
- Turus tegak dalam jadual ini dikenali sebagai kumpulan.
- Terdapat 18 kumpulan
- Semua unsur di dalam kumpulan yang sama memounyai bilangan elektron valens yang sama.
- Oleh itu, unsur-unsur di dalam kumpulan yang sama menunjukkan sifat kimia yang sama.
- Kumpulan-kumpulan ini dinamakan mengikut kedudukanya. Contohnya, kumpulan pertama dinamakan sebagai kumpulan 1 , kumpulan ke-2 dinamakan sebagai kumpulan 2 dan sebagainya.
- Antara kumpulan 2 dan 13, terletak satu blok unsur-unsur berasingan yang dipanggil unsur-unsur peralihan.
Kala
- Jadual berkala moden mempunyai 7 kala.
- Kala 1 mempunyai 2 unsur. Kala 2 hingga ke kala 3 pula mempunyai 8 unsur. Tiga kala pertama ini dikenal sebagai kala pendek.
- Kala 4 dan 5 masing-masing mempunyai 18 unsur. Kala 6 dan 7 mengandungi 32 unsur. Kesemua kala ini dikenal sebagai kala panjang.
- Dalam kala-6 terdapat 32 unsur yang tidak dapat dimuatkan dalam satu turus mengufuk yang sama. Unsur dengan nombor atom 56 – 71 disenaraikan secara berasingan di bahagian bawah Jadual Berkala. Siri unsur ini dinamakan sebagai siri lantinida.
- Dalam kala-7 terdapat 23 unsur yang tidak dapat dimuatkan dalam satu turus mengufuk yang sama. Unsur dengan nombor atom 90 – 103 disenaraikan secara berasingan di bahagian bawah Jadual Berkala. Siri unsur ini dinamakan sebagai siri aktinida.
Artikel berkaitan: Kalendar Akademik & Cuti Semester Matrikulasi 2023 / 2024
Unsur dalam Kumpulan 18
Kumpulan 18 terdiri daripada unsur berikut:
- helium (He)
- neon (Ne)
- argon (Ar)
- kripton (Kr)
- xenon (Xe)
- radon (Rn)
- oganesson (Og)
Unsur Kumpulan 18 dikenali sebagai gas adi yang mempunyai sifat lengai.
Gas adi bersifat tidak reaktif secara kimia kerana mempunyai petala valens yang telah diisi penuh dengan elektron.
Gas adi telah mencapai susunan elektron duplet atau oktet yang stabil menyebabkan atom gas adi tidak menderma, menerima atau berkongsi elektron dengan atom unsur lain.
Atom gas adi wujud sebagai monoatom.